
 Gute Analytiklabor Praxis
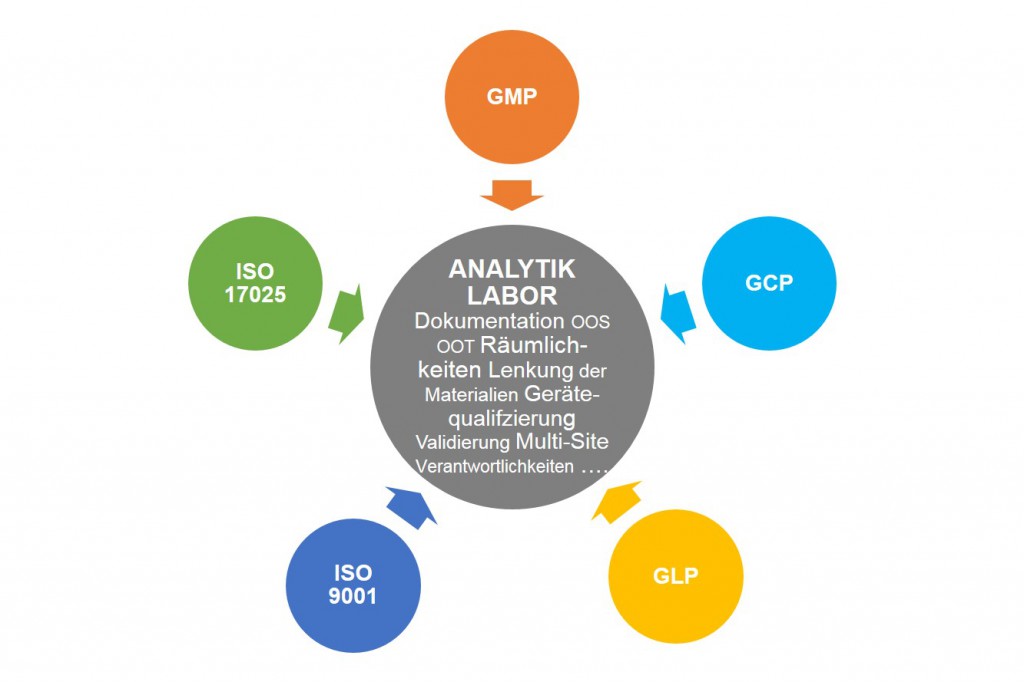
Gute Analytiklabor PraxisIn einem Labor für die Analytik unterschiedlicher Prüfgegenstände treffen verschiedene Regeln aufeinander. Das sind zum einen Anforderungen aus den Bereichen GLP, GCP, und GMP zum anderen freiwillige Normen wie ISO 17025 und ISO 9001. Fokus und Philosophie dieser Regeln sind häufig unterschiedlicher Natur. So erfüllt das eine Qualitätsmanagementsystem nicht automatisch die Zielsetzungen des anderen. Zum Beispiel ist die Dokumentation im GMP-Bereich mehr auf Freigaben von Substanzen ausgerichtet. Im GLP- Bereich hingegen beinhaltet sie komplexe Prüfungen und die gesamte Prüfeinrichtung, bei deutlich höherem Aufwand.
In unserem neu konzipierten Seminar erläutern unsere Experten, wo sich die Systeme überschneiden, wo sie sich unterscheiden und wie Elemente sinnvoll kombiniert werden können. Weiterhin stellen sie deren Begrifflichkeiten und Forderungen sowie die entsprechenden gesetzlichen Vorgaben gegenüber. Am Ende erhalten Sie einen umfassenden Einblick in die verschiedenen Anforderungen von GLP, GCP, GMP und ISO. Durch Ihr neues Wissen werden Abläufe in den unterschiedlichen Systemen transparenter, die Wünsche Ihrer Kunden verständlicher. Zudem lernen Sie, die Synergieeffekte zu erkennen und umzusetzen.
ZIELGRUPPE
Fach- und Führungskräfte, Laborleiter und Qualitätssicherungsbeauftragte aus den Bereichen: Pharmazie, Chemie und Biotechnologie mit analytischem Arbeitsgebiet.
INHALT
Einführung in den regulatorischen Hintergrund
Räumlichkeiten, Ausstattung
Dokumentation
Lenkung von Proben, Prüfsubstanzen, Reagenzien und Chemikalien
Gerätedokumentation, -qualifizierung
Validierung analytischer Methoden
Besonderheiten
DATUM, UHRZEIT, ORT
Auf Anfrage
REFERENTEN
PREIS
Auf Anfrage
KONTAKT
Bei Fragen rund um unser Seminarangebot stehen wir Ihnen gerne zur Verfügung:
| Ansprechpartner | Susan Ohlendorf |
| 040 303874 44 | |
| training@gmplan.eu |
